Педченко А.П., Шурухин А.С., Богданов Д.В.; Кузнецов А.Ф., Сухин А.И., Титов С.Ф., Ляшенко О.А., Аршаница Н.М., Екимова С.Б., Дудин А.С., Чернышова Н.Б.
Федеральное государственное бюджетное научное учреждение «Государственный научно-исследовательский институт озерного и речного рыбного хозяйства им. Л.С. Берга»
По данным многолетних наблюдений общая экологическая ситуация в акватории и на берегах Сестрорецкого Разлива требует незамедлительной реализации эффективного комплекса мероприятий по ее оздоровлению и обеспечению экологической безопасности этого важного водохозяйственного, рекреационного, культурного и социального объекта. По мнению экспертов, проект экологической реабилитации водоема должен основываться на результатах современных эколого-геологических, гидрологических, гидрохимических и гидробиологических исследований.
Комплексные экологические исследования на водоеме проводились в конце прошлого – начале нынешнего столетия и затрагивали все основные компоненты экосистемы за исключением ихтиофауны. Необходимость изучения современного состояния рыбного населения Сестрорецкого Разлива обусловила цель и задачи рыбохозяйственных исследований, проведенных на водоеме и устьевых участках его притоков реках Сестра и Черная в 2015–2016 гг.
Материалы и методы исследований
Для изучения ихтиофауны водоема проводилась неводная съемка [Пахоруков, 1980] и применялся метод с использованием жаберных сетей с разноразмерной ячеей [Appelberg, 2000]. Апробация метода в условиях восточной части Финского залива происходила под руководством специалистов института охоты и рыболовства Финляндии в рамках совместных исследований [Lappalainen, Shurukhin et al, 2000].
Сбор ихтиологического материала на акватории Сестрорецкого Разлива проводился осенью 2015-го и весной 2016 года на 11 сетных и 4 неводных станциях (рис. 1).
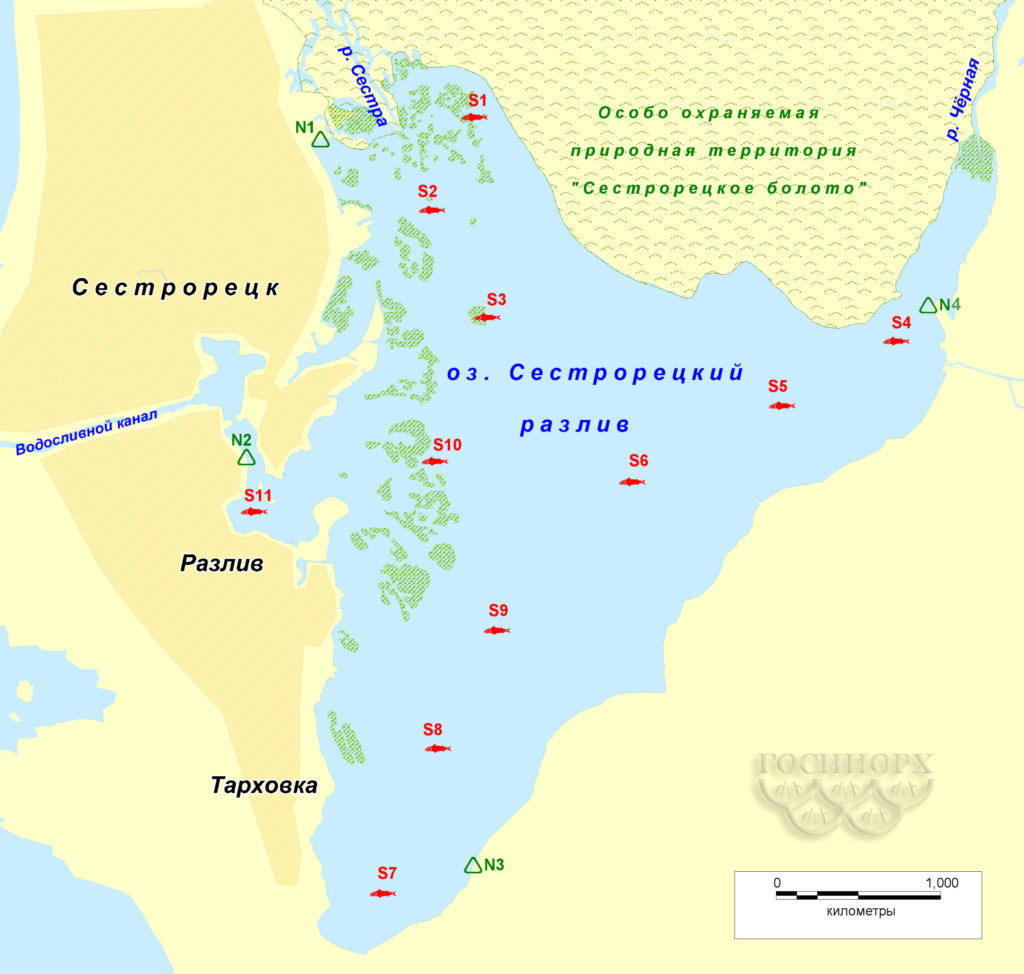
Рис. 1. Схема ихтиологических станций на Сестрорецком Разливе
S1 — S11 – сетные станции; N1 – N4 – неводные станции; • заросли камыша.
В качестве орудий лова использовались сети ставные жаберные комбинированные. Лов производился в ночное время. Продолжительность лова на каждой станции составляла не менее 12 часов (рис. 2). Для облова прибрежного биотопа использовали невод закидной, равнокрылый (рис. 3).

Рисунок 2. Выборка разноячейных жаберных сетей в Сестрорецком Разливе
Анализ видового состава уловов, параметры размерно-возрастной структуры, расчет численности и биомассы рыб, статистическая обработка полученных материалов проводились с использованием наиболее часто применяемых методик [Правдин И.Ф., 1966, Лакин Г.Ф., 1980, Песенко Ю.А., 1982, Трещев А.И., 1983, Печников А.С., Терешенков И.И., 1986]. По каждому улову определяли его массу, численность, видовой и размерный состав. Всего в процессе исследования за 2015–2016 гг. было измерено 3505 экземпляров рыб и взято на возраст и биологический анализ 678 экземпляров.

Рисунок 3. Контрольный лов мальковым неводом в Сестрорецком Разливе
Для определения состава ихтиофауны на реках Сестра и Черная, впадающих в Сестрорецкий Разлив, проведены контрольные обловы рыб. Исследования провели на трех участках (табл. 1), по своим характеристикам являющихся типичными местами обитания наиболее ценных в этом регионе лососевых видов, применена стандартная методика электролова [Обзор методов…, 2000] (рис. 4, 5). Отбор проб на биологический анализ и их обработку выполняли по стандартным методикам [Чугунова, 1959; Правдин, 1966]. Пойманная рыба взвешивалась, измерялась и выпускалась в водоем.
Таблица 1. Координаты мест проведения контрольных обловов на реках Сестра и Черная в октябре 2015 года

Рисунок 4. Река Сестра на участках облова №1 и 2

Рисунок 5. Проведение контрольного лова на реке Черная с использованием ранцевого электроловильного аппарата
Материал для проведения токсикологических, ихтиопатологических, паразитологических и гистологических исследований отбирался из сетных и неводных уловов.
Анализ проб для определения содержания тяжелых металлов осуществлялся атомно-абсорбционным методом на приборе АА-7000 по утвержденным методикам [Методика количественного… М 02-1009-08; ГОСТ 26929-94]. Ихтиопатологические исследования проводили по соответствующим методическим разработкам [Аршаница, Каримов, 1985; Аршаница, Лесников, 1987]. При наружном осмотре и вскрытии проводится дифференциальная диагностика с изменениями другой этиологии (грибковые, паразитарные заболевания и т. д.). Анализ паразитофауны осуществлялся с учетом требований к безопасности рыбной продукции [СанПиН 2.3.2.1078-01]. Камеральную обработку проб проводили согласно методическим рекомендациям [Чернышева и др., 2009]. Гистологические исследования проводились по общепринятой методике [Роскин, Левинсон, 1957].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Видовой состав ихтиофауны
По данным контрольных уловов 2015–2016 гг. ихтиофауна Сестрорецкого Разлива представлена восьмью видами рыб, принадлежащими к трем семействам: щуковые (щука), карповые (лещ, уклейка, пескарь, плотва) и окуневые (окунь, судак, ерш) (табл. 2). Все виды рыб являются типичными представителями ихтиофауны пресных водоемов Северо-Запада.
Таблица 2. Видовой состав рыбного населения Сестрорецкого Разлива по данным контрольных уловов
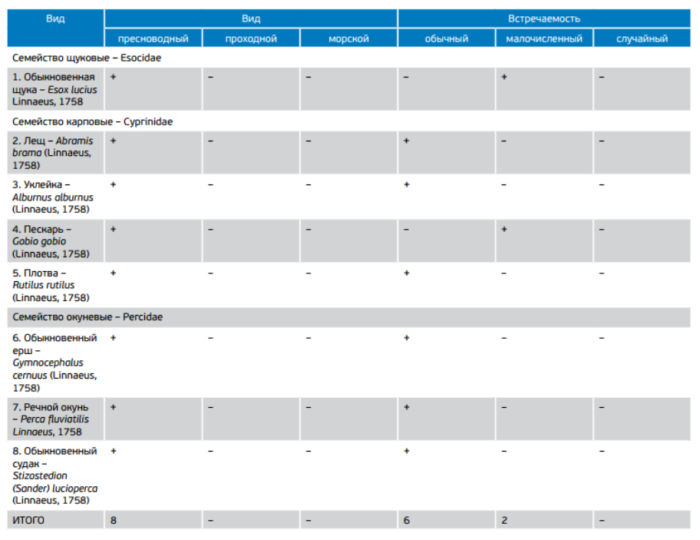
Ядро ихтиоцена представлено шестью видами рыб бореально-равнинного и понто-каспийского комплексов: плотва, ерш, лещ, окунь, судак и уклейка.
В сетных уловах наиболее многочисленным видом по численности (до 69%) и биомассе (42,8%) была плотва. Доля окуневых рыб (ерш, окунь, судак) в уловах составляла от 18,8% до 27,8% по численности и от 37,1% до 42,9% по биомассе. Щука отмечалась редко, и доля ее в уловах не превышала 0,2% по численности и 2% по биомассе.
В прибрежной зоне, где проводился неводной лов, по численности весной и осенью доминировала молодь окуневых рыб: ерша (42,5%) и окуня (29%), по биомассе – карповые: лещ и плотва, доля которых в уловах составляла от 56 до 63,2% в зависимости от сезона.
Распределение рыб
Для осеннего периода характерна высокая плотность распределения молоди рыб в зарослевой зоне водоема. На участках с открытой водой численность рыбы в уловах была значительно ниже, но биомасса находилась на том же уровне за счет наличия в уловах крупных особей (рис. 6, 7). Весной распределение рыбы по всей акватории Сестрорецкого Разлива более равномерное по сравнению с осенним периодом, что обусловлено активным перемещением рыбы по акватории водоема в результате повышения температуры воды.
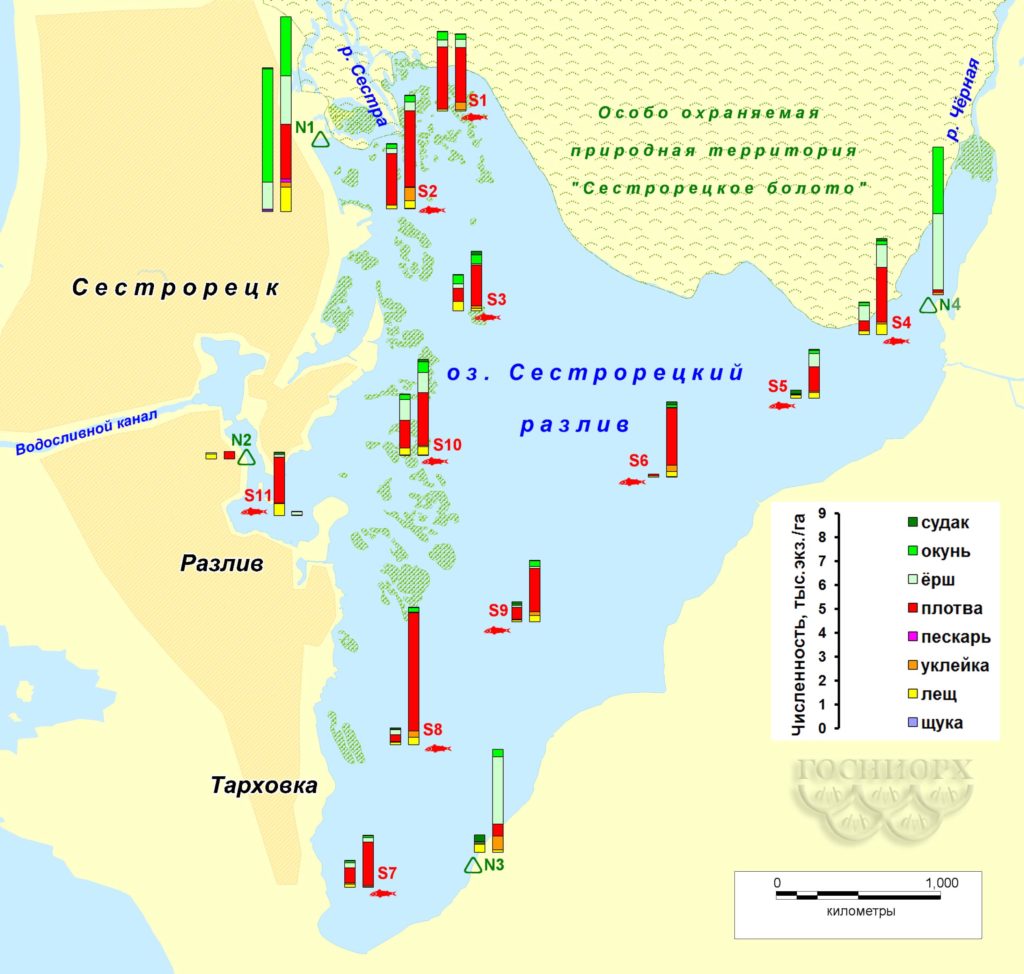
Рисунок 6. Распределение численности рыбы на акватории Сестрорецкого Разлива по данным контрольных съемок (левый столбик – осень 2015-го, правый – весна 2016 года; для станции №4 – только весна 2016-го).
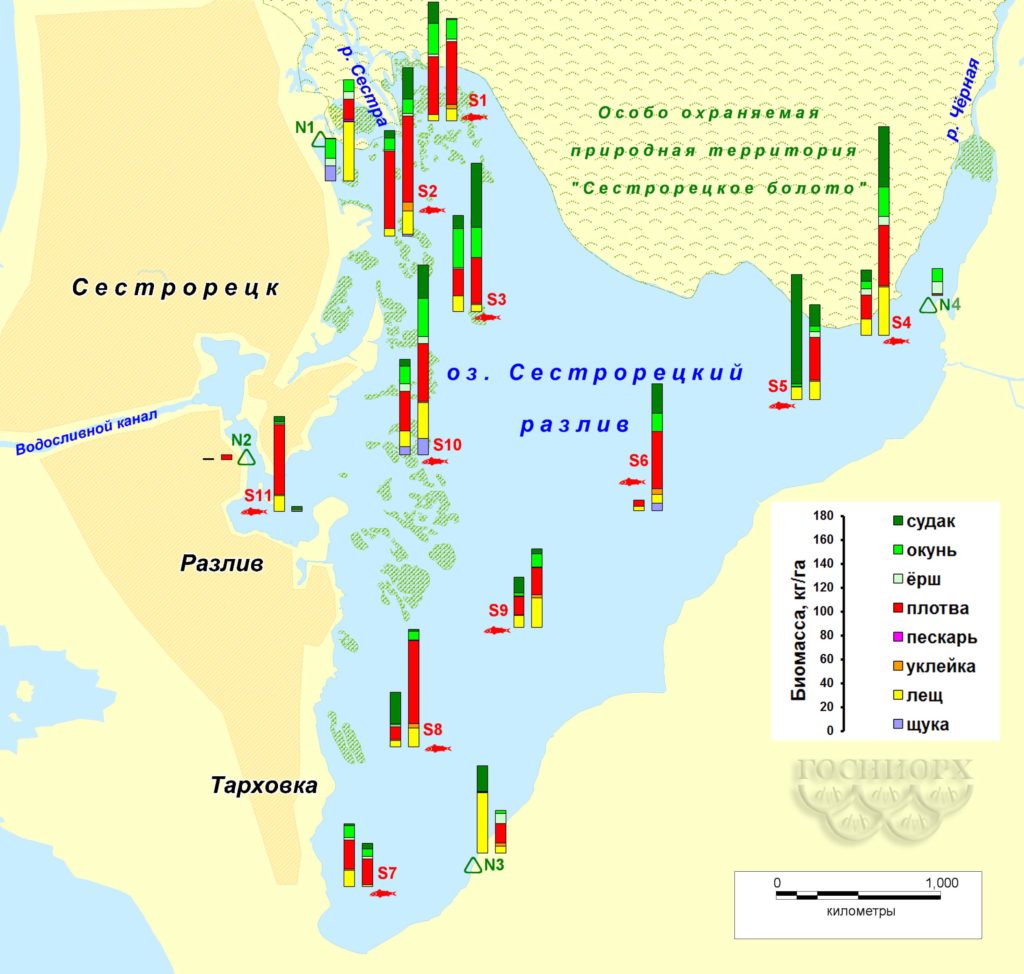
Рисунок 7. Распределение биомассы рыбы на акватории Сестрорецкого Разлива по данным контрольных съемок (левый столбик – осень 2015-го, правый – весна 2016 года; для станции №4 – только весна 2016-го).
Биологическая характеристика массовых видов рыб
Плотва – Rutilus rutilus (Linnaeus, 1758) – типичный фитофил, выбирающий для размножения мелководные участки, заросшие мягкой растительностью с глубинами обычно до 1 м. Осенью 2015 года плотва была представлена в уловах особями длиной от 6 до 19 см, массой от 6 до 162 г в возрасте 1+ – 6+ лет. Доминировали рыбы третьего года жизни длиной 7–11 см, массой 8–30 г, на долю которых пришлась половина от общего улова плотвы. Соотношение полов в этой возрастной группе составляло 1:1, из них 90% особей были неполовозрелы.
Основные биологические характеристики и размерно-возрастная структура популяции плотвы в Сестрорецком Разливе осенью 2015 года представлены на рис. 8.
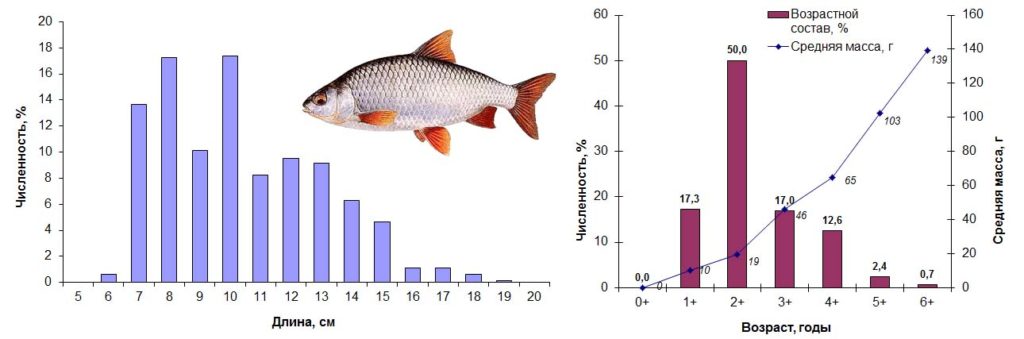
Рисунок 8. Размерно-возрастная структура экспериментальных сетных уловов плотвы осенью 2015 года
Весной 2016 года плотва по-прежнему являлась самым многочисленным видом в открытой части Сестрорецкого Разлива (сетные уловы) и к тому же появилась в прибрежных неводных уловах. В сетных уловах плотва была представлена особями длиной от 6 до 19 см, массой 5–167 г в возрасте двух–шести лет (рис. 9 а). Преобладали рыбы в возрасте два–три года (86%) длиной 8–10 см. В прибрежье (неводные уловы) плотва была мельче: диапазон размерного ряда от 3 до 15 см, масса от 1 до 70 г, возраст от одного года до пяти лет. Более половины улова составили годовики длиной 3–5 см. Доля рыб остальных возрастных групп уменьшается по мере увеличения их размеров (рис. 9 б).
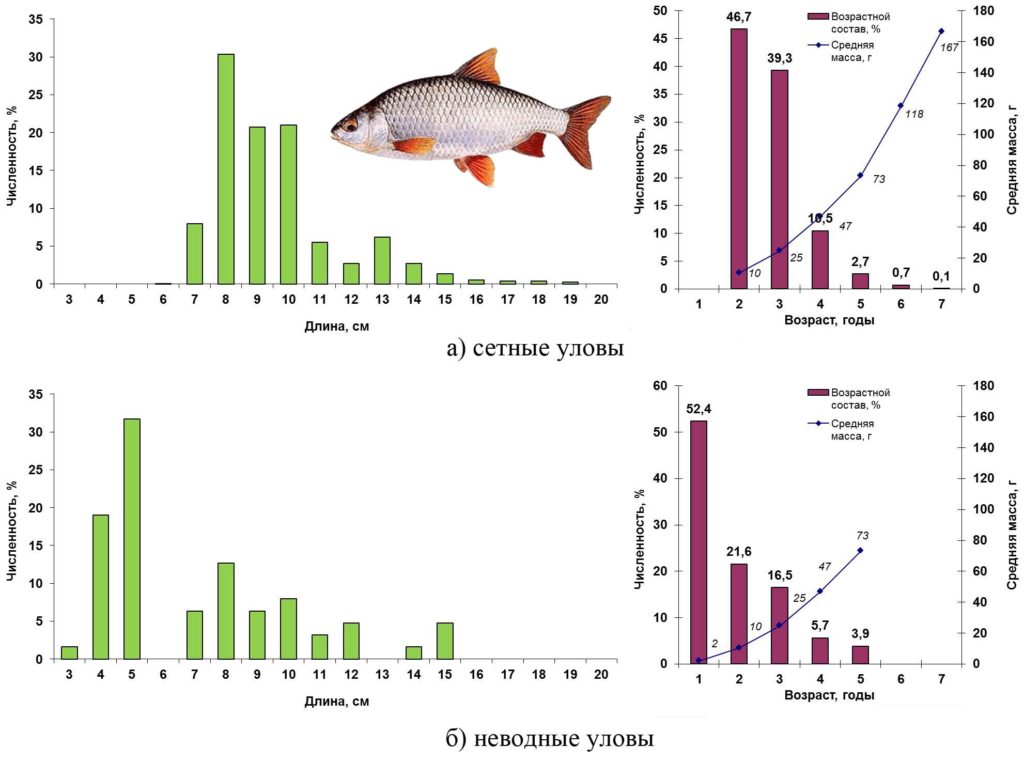
Рисунок 9. Размерно-возрастная структура экспериментальных уловов плотвы весной 2016 года
Лещ– Abramis brama (Linnaeus, 1758) –один из ценных промысловых видов, стайная рыба, часто образующая большие скопления. Осенью 2015 года лещ встречался как в прибрежье (неводные уловы), так и в открытой части водоема (сетные уловы), где был более многочислен. В сетных уловах лещ был представлен особями длиной от 7 до 23 см, массой от 8 до 254 г в возрасте 0+ – 5+ лет. Преобладали рыбы второго и четвертого года жизни с размерами 8–9 см (масса 8–21 г) и 12–14 см (масса от 35 до 91 г). Основу возрастной группы 1+ составляли ювенальные особи. Четырехлетние рыбы были представлены неполовозрелыми экземплярами (самцы численно преобладали в соотношении 3:1), 50% этой возрастной группы были ювенальны. В неводных уловах встречался лещ длиной от 3 до 22 см, массой 1–210 г в возрасте 0+ – 5+. При этом особи в возрасте 1+ и 2+ в прибрежных уловах не встречались. По численности преобладали рыбы шестого года жизни, на долю которых пришлось более половины улова. Около четверти улова составляли сеголетки.
Основные биологические характеристики и размерно-возрастная структура популяции леща Сестрорецкого Разлива осенью 2015 года представлены на рис. 10
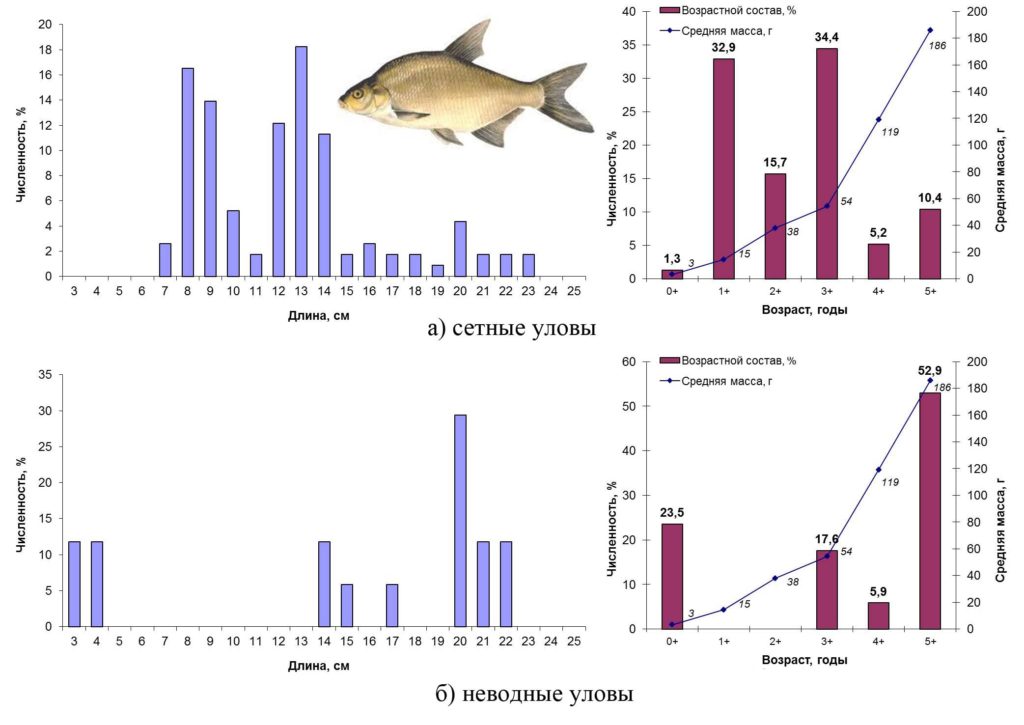
Рисунок 10. Размерно-возрастная структура экспериментальных уловов леща осенью 2015 года
В сетных уловах лещ был представлен особями длиной от 7 до 24 см, массой 8–270 г в возрасте от двух до семи лет. Преобладали трехгодовики (36%) длиной 12-14 см. В прибрежье размерный диапазон пойманного неводом леща составлял 4 – 18 см массой от полутора до 125 г в возрасте 1–5 лет. Так же как и в центральной части озера, доминировали трехгодовики (41%). Основные биологические характеристики и размерно-возрастная структура популяции леща в Сестрорецком разливе весной 2016 года представлены на рис. 11.
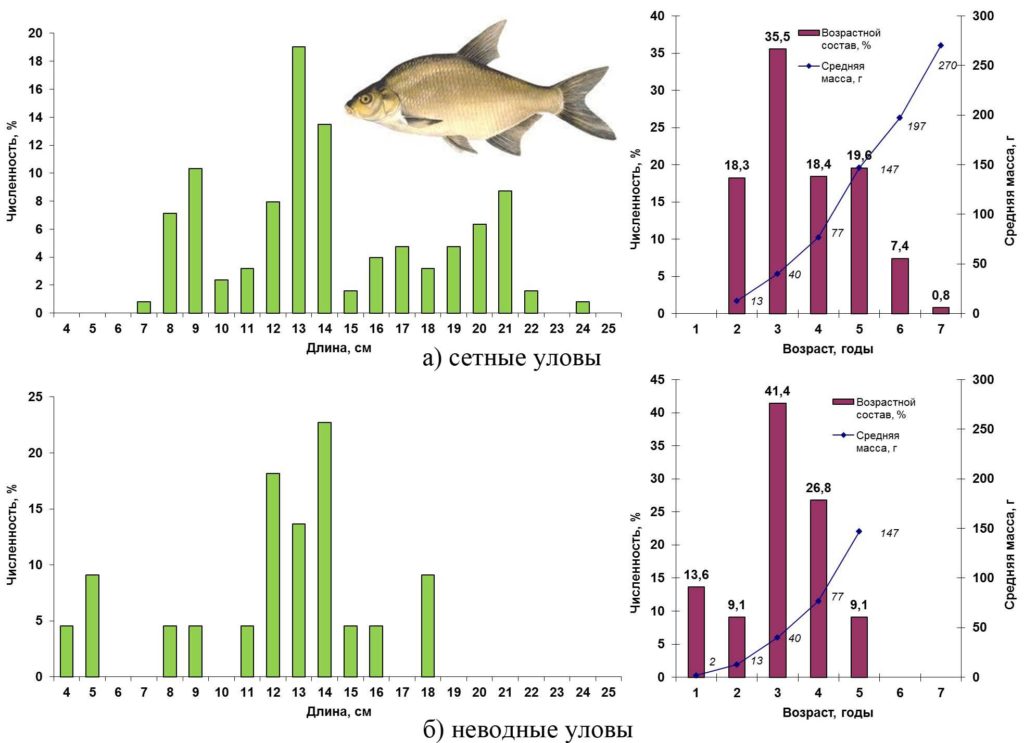
Рисунок 11. Размерно-возрастная структура экспериментальных уловов леща весной 2016 года
Окунь – Perca fluviatilis (Linnaeus, 1758) – широко распространен по всей акватории Сестрорецкого Разлива. В сетных уловах встречались рыбы длиной от 6 до 26 см, массой от 2 до 462 г в возрасте 0+ – 6+ лет. Превалировала неполовозрелая (2-я стадия зрелости) молодь (1+) длиной 6–9 см, массой от 5 до 18 г. Соотношение полов в этой возрастной группе составляло 1:1. В прибрежных неводных уловах длина окуня составляла от 4 до 13 см. Доминировали сеголетки (87%) длиной 5 см и массой 3 г.
Биологический анализ отобранного материала показал, что часть самцов (38%) окуня Сестрорецкого Разлива становятся половозрелыми уже на втором году жизни (при длине от 6 см), самки – на четвертом (от 14 см). Интенсивность питания рыб и жирность возрастали с увеличением возраста и размера рыб. Максимальные значения наблюдались у шестилетних рыб: средний балл наполнения желудка – 3,0 жирность – 3,3.
Основные биологические характеристики и размерно-возрастная структура популяции окуня Сестрорецкого Разлива осенью 2015 года представлены на рис. 12.
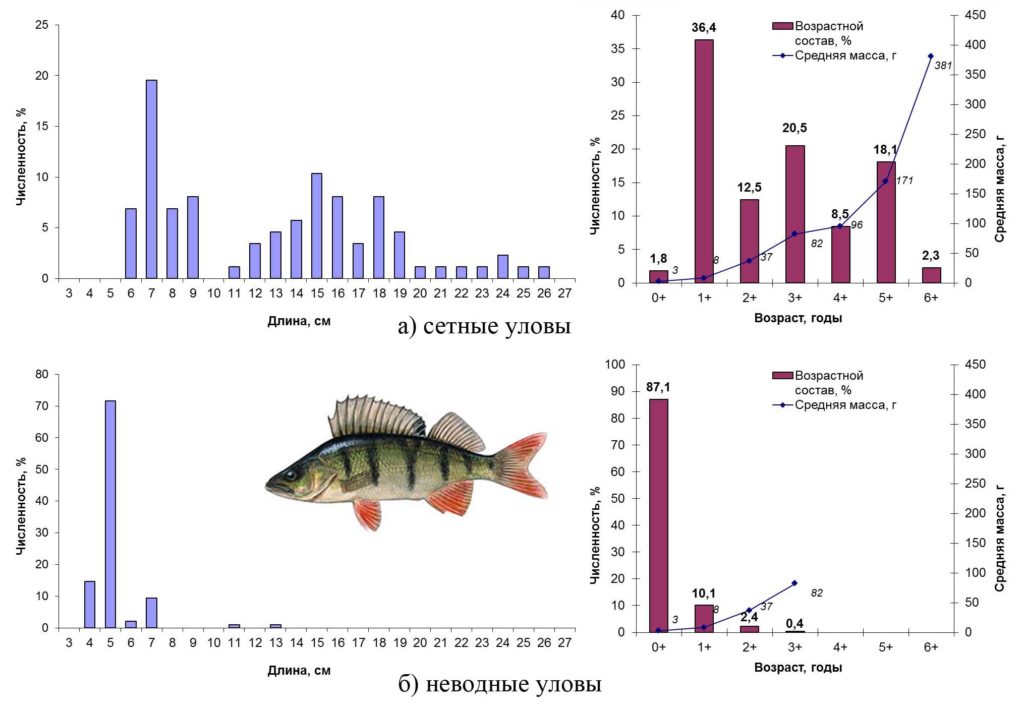
Рисунок 12. Размерно-возрастная структура экспериментальных уловов окуня осенью 2015 года
Весной 2016 года в открытой части Сестрорецкого Разлива окунь был представлен особями длиной 7–25 см, массой 5–360 г в возрасте 2–6 лет. Почти половину сетных уловов окуня составили двухгодовики. В прибрежной зоне преобладала молодь окуня – годовики длиной 4–6 см, на долю которых пришлось более 90% численности неводных уловов этого вида.
Основные биологические характеристики и размерно-возрастная структура популяции окуня Сестрорецкого Разлива весной 2016 года представлены на рис. 13.
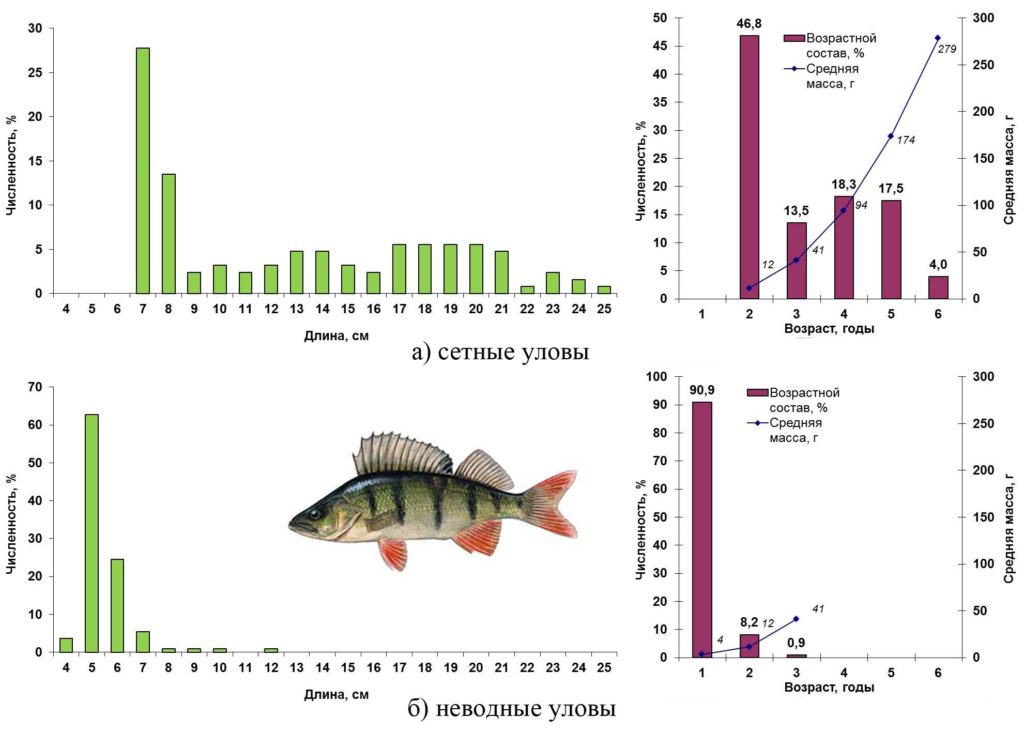
Рисунок 13. Размерно-возрастная структура экспериментальных уловов окуня весной 2016 года
Ерш – Gymnocephalus cernuus (Linnaeus, 1758) – массовый мелкочастиковый вид с коротким жизненным циклом. Осенью 2015 года в сетных уловах ерш был представлен особями длиной 4–9 см, массой 2–19 г (0+ – 5+ лет). По численности доминировали (более половины улова) рыбы четвертого года жизни длиной 6–10 см, массой 5–19 г. Все особи этой возрастной группы были половозрелые (3-я стадия зрелости гонад). Соотношение полов составляло 1:1. В прибрежье (неводные уловы) ерш был мельче за счет повышения доли молоди второго года жизни.
Биологический анализ отобранного материала показал, что самцы ерша Сестрецкого Разлива становятся половозрелыми уже на втором году жизни при длине от 5 см, самки – на четвертом (от 7 см). Интенсивность питания рыб и жирность у ерша были невысокими. Максимальные значения стадии наполнения желудка наблюдались у четырехлетних рыб 0,7, жирность (0,1) у рыб категории 5+.
Основные биологические характеристики и размерно-возрастная структура популяции ерша Сестрорецкого Разлива осенью 2015 года представлены на рис. 14.
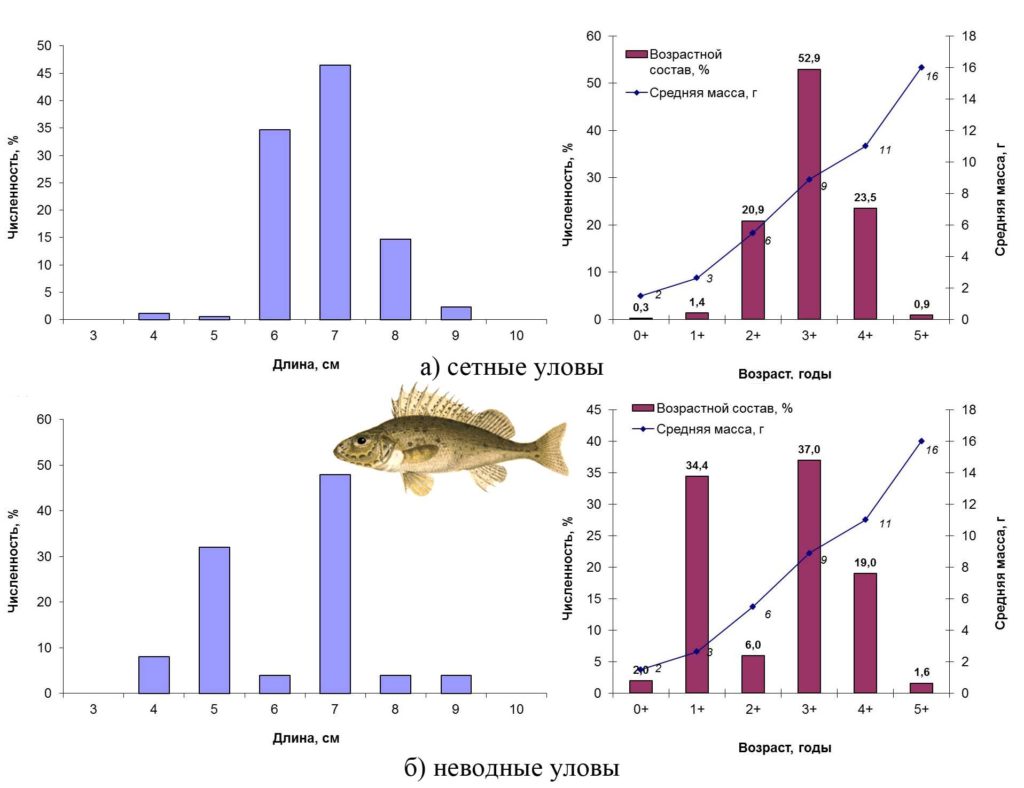
Рисунок 14. Размерно-возрастная структура экспериментальных уловов ерша осенью 2015 года
Весной 2016 года в открытой части акватории Сестрорецкого Разлива ерш был представлен особями длиной от 4 до 9 см, массой от 3 до 15 г в возрасте от года до пяти лет. Преобладали трехгодовики (6–7 см), на долю которых пришлось 58%. В прибрежной зоне ерш был мельче: в основном длиной 5 см при диапазоне от 3 до 8 см. Почти 80% составляли двухгодовики.
Основные биологические характеристики и размерно-возрастная структура популяции ерша Сестрорецкого Разлива весной 2016 года представлены на рис. 15.
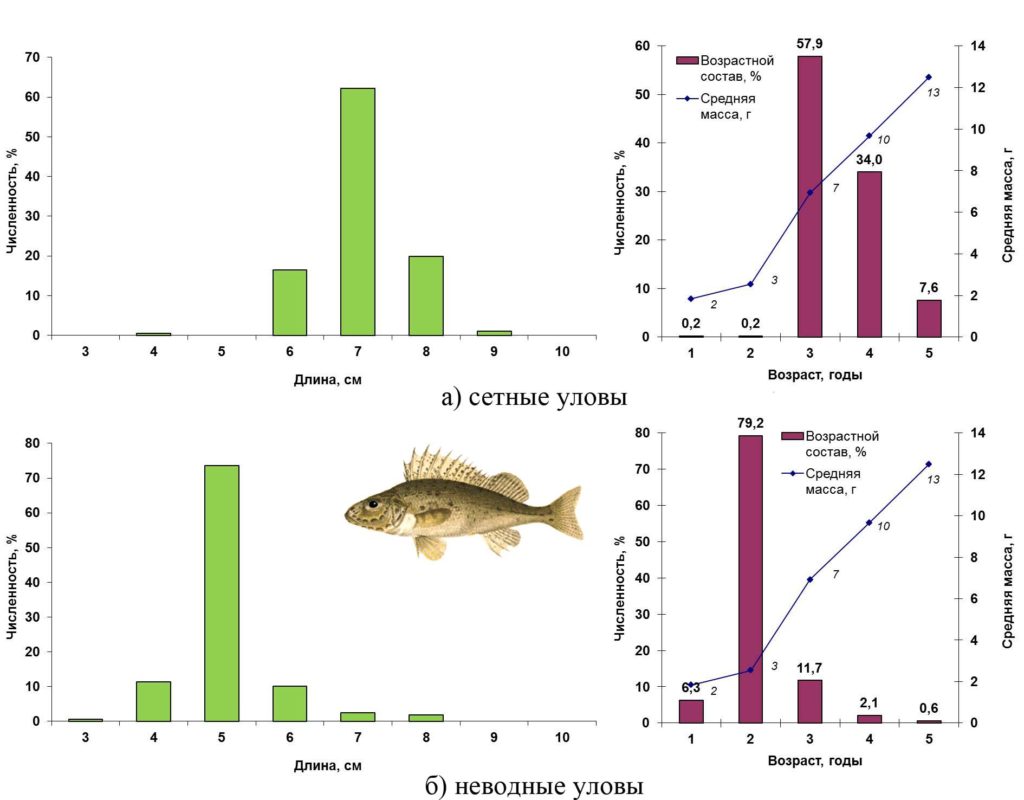
Рисунок 15. Размерно-возрастная структура экспериментальных уловов ерша весной 2016 года
Рыбопродукционные показатели Сестрорецкого Разлива и его классификация
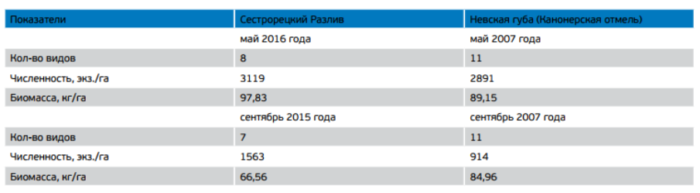
Анализ видовой структуры рыбного населения Сестрорецкого Разлива позволяет отнести его к водоемам карпово-окуневого типа, где ядро ихтиоцена формируют плотва – лещ – судак – окунь – ерш. По своим продукционным характеристикам его можно классифицировать как мезотрофный водоем [Руденко, 2000], сходный по многим параметрам ихтиоцена с наиболее продуктивными участками Невской губы (табл. 3).
Таблица 3. Сравнительные характеристики ихтиоцена Сестрорецкого Разлива и Невской губы
Ихтиофауна устьевых участков рек, впадающих в Сестрорецкий Разлив
Экспедиционные работы на двух реках, впадающих в Сестрорецкий Разлив – Сестре и Черной, показали, что ихтиофауна обловленных участков р. Сестры была представлена видами, являющимися типичными представителями т. н. «реофильного комплекса» – жилой формой кумж Salmo trutta L, подкаменщиком обыкновенным Cottus gobio L. и европейским хариусом Thymallus thymallus L. Необходимо отметить, что первые два вида являются особо охраняемыми и занесены в Красную книгу России, а третий вид является одним из самых малочисленных и требующих дополнительной охраны в реках российской части Финского залива.
Ихтиофауна на обловленном участке р. Черной (у пос. Песочный) была представлена всего двумя экземплярами плотвы Rutilus rutilus L. Бедность рыбного населения в месте облова, по нашему мнению, может объясняться неудовлетворительным экологическим состоянием водоема: в русле реки находилось большое количество бытового мусора, а от воды исходил неприятный запах.
Патологоанатомические исследования рыб Сестрорецкого Разлива и содержание в них тяжелых металлов
Водные экосистемы гидробионтов рыбы относятся к наиболее долгоживущим организмам, накапливающим информацию о действии загрязняющих веществ, поэтому результаты их патологоанатомических исследований являются хорошим биоиндикационным показателям качества среды обитания. Рыбы являются также показательными аккумулятивными индикаторами, характеризующими уровень загрязнения водного объекта устойчивыми токсикантами, в частности тяжелыми металлами, поскольку представляют обычно верхний трофический уровень водных экосистем, концентрирующий загрязняющие вещества, поступающие из низших звеньев пищевой цепи. Сведения о содержании металлов в мышечной ткани рыб важны в первую очередь, как показатель безопасности потребляемой рыбной продукции.
Результаты определения содержания металлов в мышечной ткани рыб различных видов Сестрорецкого Разлива показали, что их концентрации в пробах существенно различались, а средние концентрации не превышали как ныне действующие, так и ранее принятые нормативы (табл. 4).
Таблица 4. Концентрации тяжелых металлов в мышечной ткани рыб Сестрорецкого Разлива, мкг/г сырой массы
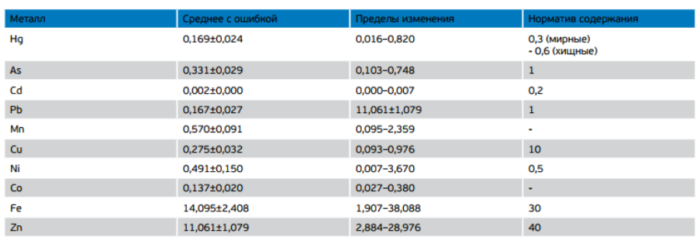
Из металлов, нормируемых в настоящее время в пищевой рыбе, только концентрация ртути превышала норматив в одной пробе окуня. В 17% проб рыб была превышена существовавшая ранее временная норма содержания никеля, в 23% – железа.
Наибольшее в среднем содержание марганца отмечено в ерше и леще, никеля (превышающее ранее применяемый норматив) – в плотве и окуне. Наибольшими концентрациями железа и цинка выделялась уклейка. Следует отметить, что средние концентрации таких нормируемых в настоящее время микроэлементов, как кадмий, свинец и мышьяк, в мышечной ткани всех исследованных видов рыб были значительно ниже норматива содержания в рыбе как продукте питания (рис. 16). Превышения концентрации ртути в мышечной ткани периодически отмечаются как в рыбе Финского залива, так и в рыбе Ладожского озера.
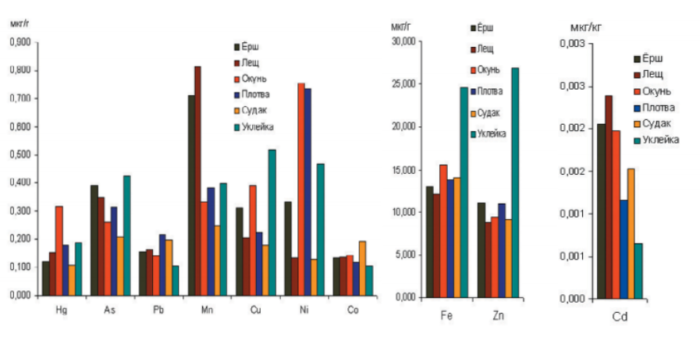
Рисунок 16. Средние концентрации тяжелых металлов в мышечной ткани разных видов рыб Сестрорецкого Разлива
Патологоанатомические исследования рыб различных видов (лещ, плотва, окунь, ерш, уклейка, щука, судак) Сестрорецкого Разлива в 2015–2016 гг. показали, что признаки хронического токсикоза не отмечены только у четверти исследованных рыб (рис. 17). Экземпляры с легкими, обратимыми повреждениями (2 балла) и с промежуточной стадией между легкими повреждениями и повреждениями средней тяжести (2,5 балла) в сумме составили 39% исследованных особей. Треть исследованных рыб составили особи со средней степенью развития токсикоза (3 балла), соответствующие патологические изменения отмечены для отдельных особей леща, окуня, щуки, ерша, судака. Наиболее неблагоприятное состояние, переходное к тяжелым необратимым повреждениям органов, вызванных токсикозом (3,5 балла), отмечено у отдельных особей леща и судака.
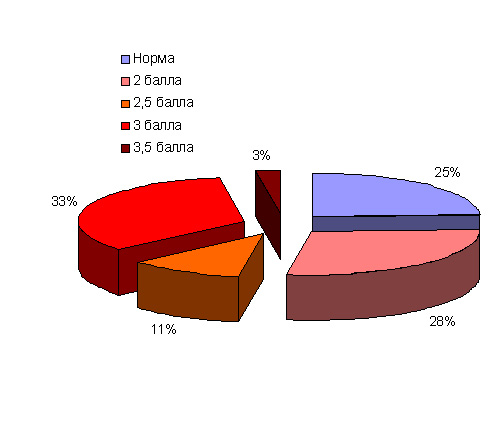
Рисунок 17. Доля рыб Сестрорецкого Разлива с различной степенью развития токсикоза
Пораженные токсикозом экземпляры принадлежали ко всем исследованным видам рыб, но наибольшая доля неповрежденных особей отмечена для планктофага – уклейки. Не обнаружено рыб с тяжелыми, необратимыми патологическими изменениями, а также с признаками острого токсикоза.
Наиболее значительные патологические изменения отмечены в печени, почке, жабрах– органах, в наибольшей степени подверженных воздействию загрязняющих веществ. В частности, в жаберной ткани отмечались отечность, изменение окраски, повышенное ослизнение; для печени были характерны локальные очаги перерождения, краевая гиперемия, слабая отечность, инъекция сосудов; в почке наблюдались кровенаполненность и отечность.
Отмеченные патологические изменения характерны для рыб водоемов Санкт-Петербурга и Ленинградской области, обитающих в условиях хронически токсичной среды обитания.
Паразитологическая ситуация на водоеме
Среди более чем двух десятков паразитов, выделенных у выловленных рыб, отмечены представители практически всех систематических групп: простейшие, миксоспоридии, плоские и круглые черви, паразитические ракообразные и моллюски. Паразитофауна рыб Сестрорецкого Разлива значительно обеднена в сравнении с сопредельными участками Финского залива.
В целом паразиты, отмеченные у плотвы и леща, отражают их биологию и соответствуют рациону – в основном в него входят растительность и зообентос. Гельминтофауна исследованных окуневых рыб указывает на преобладание в их рационе зоопланктонных организмов, через которые происходит заражение обнаруженными у них плоскими и круглыми червями. Значительно представлены и личинки плоских червей – трематод, активно заражающие хозяина. Это наглядно свидетельствует о значительном количестве моллюсков в местах обитания рыбы. По составу паразитофауны можно предположить, что исследованный окунь по большей части обитает в зарослевых участках водоема, где хищничает, при этом также питаясь зообентосом, реже зоопланктоном, в то время как для судака характерен исключительно хищнический тип питания.
При эколого-паразитологическом анализе полученных данных можно заключить, что водоем находится на начальной стадии эвтрофикации. То есть в озере происходит постепенное нарастание объема биогенных элементов, что сопровождается ростом биологической продуктивности водоема. Об этом наглядно свидетельствует преобладание в паразитофауне рыб таких групп организмов, как миксоспоридии и плоские черви – трематоды. По всей видимости, с увеличением трофности водоема все большее значение в зообентосе начинают играть малощетинковые черви (олигохеты) – промежуточные хозяева миксоспоридий. Помимо этого, изменение трофности водоема приводит к доминированию специфичной паразитофауны, где на первые места выходят личинки трематод. Также возрастает зараженность рыб паразитами, активно инвазирующими хозяина и заканчивающими свой цикл развития в рыбоядных птицах.
Помимо этого, простые наблюдения и последовавшие за ними лабораторные изучения позволили сделать еще одно интересное замечание. Наверняка многие рыбаки, да и просто люди, внимательные к природе, неоднократно могли наблюдать довольно крупных лещей, необычно плавающих у поверхности водоема. В ходе проведенных исследований было установлено, что лещ, обитающий в Сестрорецком Разливе, практически на 100% заражен личинками плоского червя (цестоды) Ligula intestinalis (рис. 18).

Рисунок 18. Плероцеркоид цестоды Ligula intestinalis в полости тела леща
Паразитирующие в полости тела рыбы, личинки (плероцеркоиды) нередко в длину превышают размер своего хозяина в несколько раз. Следует сказать, что рыба является лишь одним из хозяев этого паразита. Для продолжения развития личинке цестоды нужно попасть в организм так называемого окончательного хозяина, в котором паразит начнет размножаться. Таким окончательным хозяином для лигулы будут рыбоядные птицы, а именно чайки, поганки, крохали, бакланы и пр. В организме птицы червь претерпевает половое созревание, по окончании которого начинает производить огромное количество яиц. Яйца вместе с экскрементами попадают в воду, где заражают рачков (любимое лакомство рыбы), и таким образом цикл замыкается. Как видим, ни на одном из этапов не присутствует ни человек, ни какое-либо млекопитающее. Можно предположить возможность попадания в их организм любой из стадий лигулы, но в силу ряда физиологических особенностей развиваться она не будет. Из всего этого можно заключить, что такая зараженная рыба не может представлять опасности для здоровья людей и домашних животных.
Возникновение на озере очага лигулеза можно связать с существованием сразу нескольких благоприятных для развития паразита факторов. В первую очередь это присутствие значительного числа рыбоядных птиц – окончательных хозяев лигулы. Также существенное значение может иметь и отсутствие регулярного вылова рыбы. По имеющимся данным, значительное увеличение уровня зараженности молоди рыб личинками лигулы может свидетельствовать о недостаточной численности хищников в водоеме.
Методов лечения для этого заболевания не разработано, и использование их на столь крупных водоемах представляется мало выполнимым. Как правило, для борьбы с лигулезом проводят комплекс мероприятий, основанный на особенностях биологии паразита. Необходимо выполнить отлов максимального количества зараженной рыбы, прибегнуть к отпугиванию рыбоядных птиц, а также препятствованию их гнездования на территории водоема, к примеру, выкашивая жесткую растительность.
Заключение
В результате выполненных исследований впервые получены данные по составу ихтиофауны водоема, структуре ихтиоцена, пространственному распределению рыб в водоеме и их биологическим характеристикам. Выявлены признаки легкой степени развития токсикоза у большинства обследованных особей, который имеет обратимый характер. Выявленные признаки токсикоза указывают на воздействие загрязняющих веществ, связаны преимущественно с нарушением гемодинамики и характерны для рыб водоемов Санкт-Петербурга и Ленинградской области.
Содержание тяжелых металлов, кадмия, свинца, меди, цинка, ртути и мышьяка в исследованных рыбах было значительно ниже нормативов содержания этих элементов в пищевой рыбе. Такая степень загрязнения рыбы характерна для многих водоемов Санкт-Петербурга и Ленинградской области.
По результатам проведенных паразитологических исследований не выявлено паразитов, представляющих опасность для здоровья человека и отмеченных в СанПиН 3.2.1333-03, также не было выявлено паразитов, которые могли бы существенным образом повлиять на численность популяции рыб. Необходимо применение мер профилактики лигулеза и оздоровления водоема, основанных на прерывании жизненного цикла паразита, таких как отпугивание рыбоядных птиц, массовый вылов зараженной рыбы, а также применение мер, направленных на увеличение численности хищных рыб, в частности судака или щуки.
Сравнительно высокая плотность рыбного населения, видовой состав обитающих рыб характеризуют данный водоем как перспективный для развития спортивно-любительского рыболовства для жителей Санкт-Петербурга.


Создать комментарий